Денатурация белков
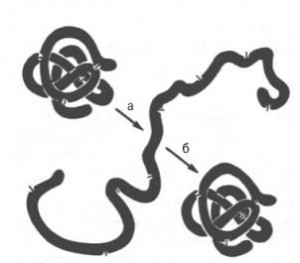
При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и молекула целиком или в значительной части принимает форму случайного беспорядочного клубка (случайного в том смысле, что каждая молекула данного индивидуального белка по конформации может отличаться от всех других молекул).
Такое изменение белка называют денатурацией. Денатурацию можно вызвать нагреванием до 60-80 °С или действием других агентов, разрушающих нековалентные связи в белках. Денатурация происходит на поверхности раздела фаз, в кислых или, наоборот, щелочных средах, при действии ряда органических соединений — спиртов, фенолов и др.; часто для денатурации применяют мочевину или гуанидинхло-рид. Эти вещества образуют слабые связи (водородные, ионные, гидрофобные) с аминогруппами или карбонильными группами пептидного остова и с некоторыми группами радикалов аминокислот, подменяя собственные внутримолекулярные водородные связи в белке, вследствие чего вторичная и третичная структуры изменяются.Устойчивость к денатурирующим агентам в большой мере зависит от наличия дисульфидных связей в молекуле белка. В ингибиторе трипсина (панкреатический белок) есть три S — S-связи. Если их восстановить, то происходит денатурация без других денатурирующих воздействий. Если затем белок поместить в окислительные условия, в которых происходит окисление SH-групп цистеина и образование дисульфидных связей, то исходная конформация восстанавливается. Даже единственная дисульфидная связь существенно повышает стабильность пространственной структуры.
Денатурация обычно сопровождается снижением растворимости белка; при этом часто образуется осадок «свернувшегося белка», а если концентрация белков в растворе достаточно велика, то «свертывается» вся масса раствора, как это происходит при варке куриного яйца. При денатурации утрачивается биологическая активность белков. На этом основано применение водного раствора фенола (карболовая кислота) в качестве антисептика.
Лабильность пространственной структуры белков и большая вероятность их денатурации при разнообразных воздействиях создают значительные затруднения при выделении и изучении белков, а также при их использовании в медицине и промышленности.
В определенных условиях при медленном охлаждении раствора денатурированного нагреванием белка происходит ренативация — восстановление исходной (нативной) конформации (см. рис. 1.20, 4). Это подтверждает, что характер укладки пептидной цепи определяется первичной структурой белка. Процесс образования нативной конформации белка самопроизвольный, т. е. эта конформация отвечает минимуму свободной энергии молекулы. Можно сказать, что пространственная структура белка закодирована в аминокислотной последовательности пептидных цепей. Это означает, что все идентичные по чередованию аминокислот полипептиды (например, пептидные цепи миоглобина) будут принимать идентичную же конформацию. Однако из этого правила есть исключения. Капсид (оболочка) вируса кустистости томатов содержит белок, построенный из субъединиц А, В и С; первичная структура этих субъединиц идентична, а конформация различна. Известны идентичные олигопептидные последовательности (около 5 аминокислотных остатков), которые в одних белках образуют а-спирали, в других — р-структуры. Таким образом, нативная конформация каждого участка пептидной цепи зависит не только от его первичной структуры, но и от ближайшего окружения.
Белки, имеющие одинаковую или почти одинаковую конформацию, могут существенно различаться по первичной структуре. Например, миоглобин, а-прото-меры и [3-протомеры гемоглобина имеют почти одинаковую конформацию (см. рис. 1.9), но их первичная структура заметно различается: примерно в 70 % позиций аминокислоты не совпадают. Однако в таких случаях несовпадающие аминокислоты, как правило, сходны по физико-химическим свойствам боковых цепей.