Рубрика ‘Биологическая химия’
В организмах в процессе биологической эволюции, а также в технике при разработке химических технологических процессов отбирались в качестве катализаторов такие вещества, реакции с которыми протекают очень быстро — в тысячи, в миллионы, даже в 1010 раз быстрее, чем соответствующие некаталитические реакции.
- Катализируемые реакции.
Читать дальше »
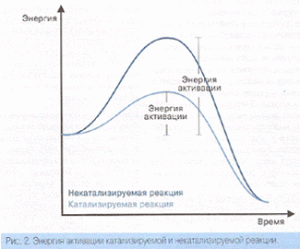
Скорость реакции чаще всего определяется ее энергией активации, т. е. той энергией, которую нужно сообщить молекулам, чтобы началось химическое превращение.
Чем больше энергия активации, тем меньше скорость реакции. Энергия активации зависит от природы реагирующих молекул, от их внутреннего строения. Например, энергия активации реакции S02 с кислородом больше, чем энергия активации реакции S02 с N02.
- Энергия активации реакций.
Читать дальше »
Наиболее характерная черта, отличающая ферменты от других катализаторов — высокая специфичность их действия. Активный центр ферментов, как и других белков, образован боковыми группами аминокислотных остатков пептидной цепи. Строение активных центров ферментов, катализирующих разные реакции, различно.

- Действие ферментов.
Читать дальше »
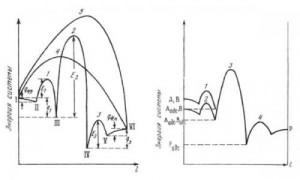
Ферменты, как и другие катализаторы, не изменяют состояния равновесия, а лишь ускоряют его достижение. Например, если внести фумаразу в раствор фумаровой кислоты, то можно зарегистрировать реакцию фумарат -> малат*; если же внести тот же фермент в раствор яблочной кислоты (малат), то можно наблюдать реакцию малат -> фумарат. И в том и в другом случае достигается равновесное состояние, при котором отношение [фумарат] / [малат] = Напомним, что химические реакции самопроизвольно протекают в направлении, которое связано с уменьшением в системе свободной энергии AG (энергии Гиббса) — экзергони-ческие реакции.

- Ферментативная реакция.
Читать дальше »
Многие ферменты для проявления каталитической активности нуждаются в присутствии некоторых веществ непептидной природы — кофакторов. Различают две группы кофакторов: ионы металлов (а также некоторые неорганические анионы) и коферменты, которые представляют собой органические вещества.Примерно треть всех известных ферментов содержит ион металла или активируется ионами металла.
- Кофактор ферментов.
Читать дальше »
Реакции трансаминирования проходят в две стадии (полуреакции). Если к раствору фермента добавить только один из двух субстратов — аланин, то произойдет первая полуреакция. Аминогруппа аланина присоединяется к углероду альдиминной группы фермента: альдиминная связь между кофермен-том и белком заменяется на альдиминную связь между коферментом и аланином.
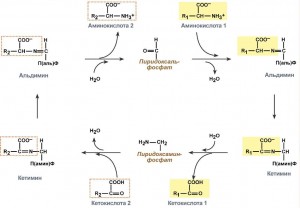
- Трансаминирование.
Читать дальше »
В реакциях, катализируемых этими ферментами, в качестве кофермента участвует никотинамидадениндинуклеотид (НАД). Две половины молекулы НАД,объединенные связью между остатками фосфорной кислоты, построены по одинаковому плану. Одна половина представляет собой остаток нуклеотида (адениловой кислоты).
- Дегидрогеназы.
Читать дальше »
Молекула кофермента А построена из аденозин-3'-фосфат-5'-пирофосфата, соединенного сложноэфирной связью с пантотеновой кислотой, которая, в свою очередь, соединена амидной связью с р-меркаптоэтиламином (тиоэтаноламином).
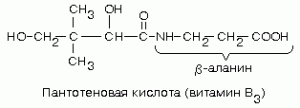
- Кофермент.
Читать дальше »
Лиазы. К лиазам принадлежат декарбоксилазы, отщепляющие карбоксильную группу от органических кислот, например уже упоминавшаяся гистидиндекарбок-силаза; альдолазы, расщепляющие углерод-углеродную связь с образованием альдегида; гидратазы, присоединяющие воду по двойной связи (например, фумара-за); дегидратазы, отщепляющие от соединений молекулу воды с образованием двойной связи.
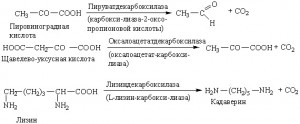
- Различные лиазы.
Читать дальше »
Зависимость скорости реакции от температуры. Скорость ферментативных реакций, как и всяких других, зависит от температуры: при повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур — до 50-60 °С.
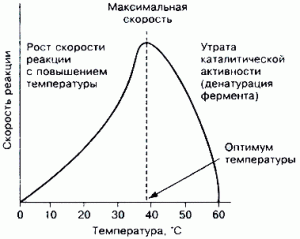
- Зависимость скорости от температуры.
Читать дальше »














