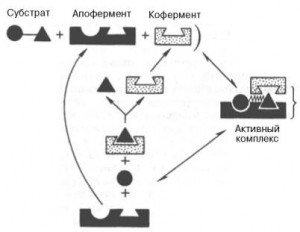
Рассмотрим в качестве примера хорошо изученный фермент карбоксипептидазу А. Механизм действия этого фермента выяснен путем рентгеноструктурного исследования комплексов фермента с разными ингибиторами и псевдосубстратами.
Карбоксипептидаза А построена из одной пептидной цепи, включающей 307 аминокислотных остатков; фермент содержит ион Zn2+ в активном центре. Размеры молекулы 5×4,2×3,8 нм. Активный центр фермента расположен в нише глубиной около 1 нм. Карбоксипептидаза А — пищеварительный фермент, образующийся в поджелудочной железе и в составе сока этой железы поступающий в кишечник. Здесь он участвует в переваривании белков: катализирует отщепление С-концевых аминокислотных остатков от пептидов.
На рис. 2.23 показана С-концевая часть субстрата (два аминокислотных остатка) в активном центре карбоксипептидазы А. В связывании субстрата и катализе участвуют аминокислотные остатки Tyr248, Argl45, Glu270 карбоксипептидазы и ион Zn2+, который соединен с карбоксильной группой Glu72 и, кроме того, двумя координационными связями — с имидазольными циклами His69 и His 196. В активном центре имеется углубление, содержащее гидрофобные радикалы аминокислот (гидрофобный карман). В этот карман входит радикал С-концевой аминокислоты субстрата, поэтому наилучшими субстратами карбоксипептидазы А являются пептиды с гидрофобной С-концевой аминокислотой (радикал Rco на рис. 2.23).
Реакция начинается со взаимодействия Rco с гидрофобным карманом и образования ионной связи карбоксильной группы субстрата с гуанидиновой группой Argl45. При этом пептидная цепь в области Argl45 подтягивается в сторону карбоксильной группы субстрата (примерно на 0,2 нм). Это ведет к конформационным перестройкам и в других частях активного центра: в направлении к субстрату перемещаются Glu270 (на 0,2 нм) и Туг248 (на 1,2 нм). В результате возникает взаимодействие карбонильной группы субстрата с карбоксилом Glu270 и атомом Zn, а также атома азота пептидной связи с ОН-группой Туг248. Пептидная связь при этом ослабляется, и происходит ее гидролиз, приводящий к образованию карбоксильной группы аминокислотного остатка R и аминогруппы C-концевого остатка. Эти группы не могут взаимодействовать с функциональными группами активного центра, т. е. комплементарность нарушается: продукты гидролиза покидают активный центр, а фермент восстанавливает исходную конформацию.
Конечно, строение активного центра и механизмы действия разных ферментов различны, они соответствуют особенностям строения субстрата и типу реакции. Однако приведенный пример иллюстрирует некоторые общие черты, характерные для ферментативного катализа. Эти черты перечислены ниже.
1. Активный центр фермента формируется из участков пептидной цепи и отдельных аминокислотных остатков, содержащих разные функциональные группы. Субстрат соединяется с активным центром в нескольких точках; это обеспечивает высокую избирательность связывания (комплементарность субстрата и активного центра) и ориентацию субстрата, необходимую для катализа реакции.
2. Активный центр, как правило, располагается в углублении (в нише, в щели) поверхности фермента. В результате субстрат, соединяясь с активным центром, оказывается не в водной среде цитозоля клетки, а в специфическом окружении функциональных групп активного центра.
3. В ходе присоединения субстрата и в ходе катализа происходят конформа-ционные изменения молекулы фермента и субстрата.