Цель курса биохимии — научить будущих врачей применять при изучении последующих дисциплин и в профессиональной врачебной деятельности сведения о химическом составе и молекулярных процессах организма как о характеристиках нормы и признаках патологии. Исходя из этого, в предлагаемом издании особое внимание уделяется сведениям о непосредственной связи молекулярных процессов с физиологическими (биологическими) функциями клетки и организма.
- Цель курса.
Читать дальше »
Биологическая химия изучает молекулярные процессы, лежащие в основе развития и функционирования организмов. Биохимия использует методы «молекулярных» наук — химии, физической химии, молекулярной физики, и в этом отношении биохимия сама является молекулярной наукой.

- Биохимия.
Читать дальше »
Первоначальные этапы истории биохимии совпадают с историей органической химии. До середины XIX в. органической химией называли науку, которая изучала вещества, входящие в состав животных и растительных организмов, т. е. вещества живого («органического») мира. Позднее, в связи с развитием синтетической химии соединений углерода, смысл термина «органическая химия» изменился — так теперь называют химию соединений углерода, а науку, изучающую химический состав живых организмов и химические процессы, протекающие в них, стали называть физиологической, а затем биологической химией.
- Первоначальные этапы.
Читать дальше »
Представление о белках как о классе соединений формировалось в XVIII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, хрусталик глаза, кровь, молоко и т. п.) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие, клейкие растворы, свертывались при нагревании, при их высушивании получалась роговидная масса, при «анализе огнем» ощущался запах паленой шерсти или рога и выделялся аммиак.
- Белки как класс соединений.
Читать дальше »
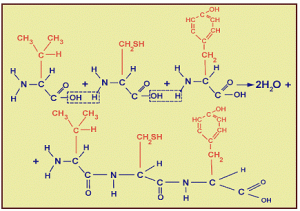
Мономерами белков служат а-аминокислоты, общим признаком которых является наличие карбоксильной группы и аминогруппы у второго углеродного атома (а-углеродный атом). Мономерами белков служат а-аминокислоты, общим признаком которых является наличие карбоксильной группы и аминогруппы у второго углеродного атома (а-углеродный атом).

- Аминокислоты.
Читать дальше »
Первичной структурой называют порядок чередования (последовательность) аминокислотных остатков в белке. Даже идентичные по длине и аминокислотному составу пептиды могут быть разными веществами. Например, из двух аминокислот — аланина и тирозина — можно построить два пептида: Ala—Туг и Туг—Ala. Из трех аминокислот можно получить шесть различных по первичной структуре трипептидов.
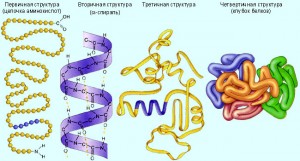
- Структуры белков.
Читать дальше »
Протомеры соединяются в результате образования гидрофобных, ионных, водородных связей. При этом протомеры взаимодействуют друг с другом не любой частью своей поверхности, а определенным участком (контактная поверхность). Между каждой парой взаимодействующих контактных участков образуются десятки связей.
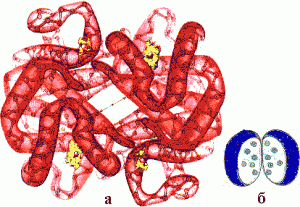
- Комплементарность.
Читать дальше »
Олигомерные белки обладают особыми свойствами, которых нету белков, не имеющих четвертичной структуры. Это можно увидеть, сравнивая белок мышц ми-оглобин и белок эритроцитов гемоглобин. Вторичная и третичная структуры ми-оглобина и протомеров гемоглобина очень сходны. Оба эти белка являются гемопротеинами и выполняют в организме сходные функции, в основе которых лежит способность обратимо связывать кислород.
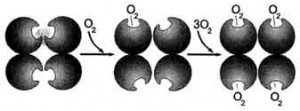
- Кооперативные изменения.
Читать дальше »
Характерная структурная особенность фибриллярных белков — вытянутая, нитевидная форма молекул. Эти белки нерастворимы в воде и часто образуют многомолекулярные нитевидные комплексы — фибриллы.
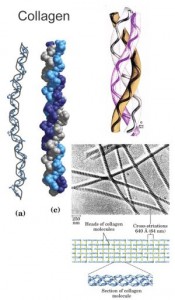
- Фибриллярный белок.
Читать дальше »
Нет сомнений, что белки выполняют в живой клетке наиболее разнообразные и наиболее интересные функции. Как уже было отмечено, в организме человека количество разных белков исчисляется десятками тысяч. Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающуюся от функций всех других белков.
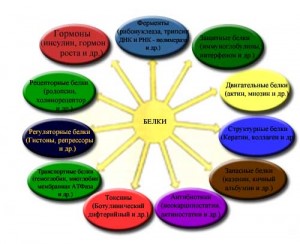
- Функции биологических белков.
Читать дальше »














