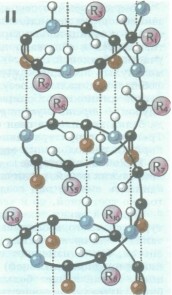
Вторичная структура белков
Вторичная структура белков обусловлена прежде всего свойствами пептидного остова. Карбонильная группа и NH-группа способны образовывать водородную связь между собой:Минимуму свободной энергии соответствует такое состояние пептида, когда все эти группы связаны водородной связью.
Иначе говоря, пептид стремится принять конформацию с максимумом водородных связей. С другой стороны, возможности пространственной укладки пептидной цепи ограничиваются тем, что пептидная связь имеет частично двойной характер, и поэтому вращение вокруг нее невозможно. Атомы кислорода и водорода пептидной группы занимают трансположение. Напротив, вокруг обеих связей группы —СН— пептидного остова возможно свободное вращениеследствие этих ограничений при образовании водородных связей пептидная цепь принимает не произвольную, а строго определенную конформацию.
Известны три основных типа вторичной структуры пептидных цепей: ос-спираль, р-структура (складчатый слой, складчатый листок) и беспорядочный клубок.В а-спирали NH-группа данного остатка аминокислоты взаимодействует с СО-группой четвертого от него остатка. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 аминокислотного остатка. Водородные связи ориентированы вдоль оси спирали, соединяя ее витки