Рубрика ‘Биологическая химия’
По форме молекулы и особенностям пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Форма глобулярных белков близка к сферической или эллипсоидной, с отношением короткой и длинной осей до 1:50. Молекулы фибриллярных белков имеют удлиненную форму и могут образовывать многомолекулярные нитевидные агрегаты — фибриллы.

- Фибриллярные белки.
Читать дальше »
Основную роль в образовании третичной структуры играют нековалентные взаимодействия между радикалами аминокислот — водородные, ионные, гидрофобные связи. Аминокислоты, входящие в белки, различаются по физико-химическим свойствам радикалов. Между аминокислотами с неполярными (гидрофобными) радикалами возможны гидрофобные взаимодействия; между полярными радикалами возникают водородные связи, а между заряженными полярными радикалами — ионные.
- Связи в белках.
Читать дальше »
Длинные полипептидные цепи (длиной около 200 аминокислотных остатков или больше) обычно имеют доменную пространственную структуру. Доменом называют часть пептидной цепи, образующей как бы самостоятельную глобулу, причем на одной пептидной цепи может быть два или больше доменов.
- Доменная структура.
Читать дальше »
При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и молекула целиком или в значительной части принимает форму случайного беспорядочного клубка (случайного в том смысле, что каждая молекула данного индивидуального белка по конформации может отличаться от всех других молекул).
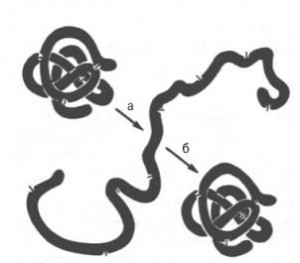
- Денатурация.
Читать дальше »
Денатурация белков с небольшой скоростью происходит и в живой клетке. Ренативация денатурированных белков в условиях клетки затруднена вследствие высокой концентрации белков: денатурированные молекулы обнажившимися гидрофобными участками соединяются с другими молекулами, что препятствует правильной укладке пептидной цепи.
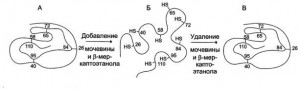
- Денатурация и ренативация.
Читать дальше »
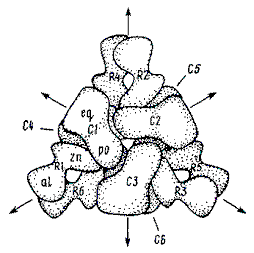
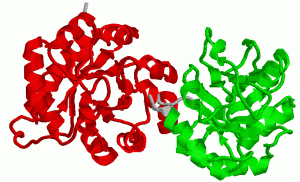
Многие белки построены из двух или более пептидных цепей, соединенных неко-валентными связями. Такие белки могут распадаться на составляющие их пептидные цепи при сравнительно небольших изменениях среды, например при подкис-лении, подщелачивании, добавлении гидрофобных веществ, охлаждении, а также при действии денатурирующих агентов. Примером может служить основной белок эритроцитов — гемоглобин (НЬ).
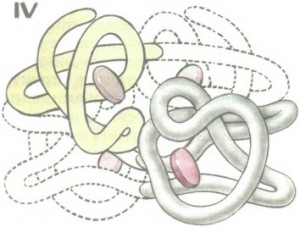
- Четвертичная структура.
Читать дальше »
Протомеры соединяются в результате образования гидрофобных, ионных, водородных связей. При этом протомеры взаимодействуют друг с другом не любой частью своей поверхности, а определенным участком (контактная поверхность). Между каждой парой взаимодействующих контактных участков образуются десятки связей.
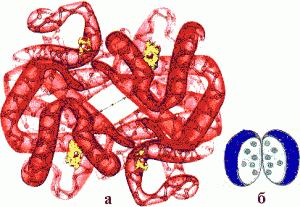
- Комплементарность.
Читать дальше »
Олигомерные белки в строгом смысле нельзя назвать молекулами: скорее это надмолекулярные структуры, занимающие промежуточное положение между молекулами и клеточными органеллами, такими, как шаперониновый комплекс, рибосомы, хромосомы, мембраны и др. Таким образом, здесь намечается путь к пониманию того, как на основе химических и физико-химических свойств возникают структуры и свойства, характерные для биологической формы движения материи.

- Надмолекулярные структуры.
Читать дальше »
Олигомерные белки обладают особыми свойствами, которых нету белков, не имеющих четвертичной структуры. Это можно увидеть, сравнивая белок мышц ми-оглобин и белок эритроцитов гемоглобин. Вторичная и третичная структуры ми-оглобина и протомеров гемоглобина очень сходны. Оба эти белка являются гемопротеинами и выполняют в организме сходные функции, в основе которых лежит способность обратимо связывать кислород.
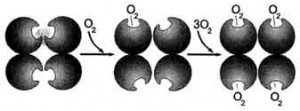
- Кооперативные изменения.
Читать дальше »
Один из распространенных методов определения молекулярной массы белков и других высокомолекулярных веществ основан на измерении скорости седиментации (осаждения) веществ при ультрацентрифугировании. Во вращающемся роторе ультрацентрифуги центробежное ускорение достигает 100 000-500 000 g (g — ускорение свободного падения). На поверхность буферного раствора, налитого в кювету ультрацентрифуги, наносят тонкий слой раствора белка и кювету помещают в ротор.
- Молекулярные массы.
Читать дальше »














