Первоначальные этапы истории биохимии совпадают с историей органической химии. До середины XIX в. органической химией называли науку, которая изучала вещества, входящие в состав животных и растительных организмов, т. е. вещества живого («органического») мира. Позднее, в связи с развитием синтетической химии соединений углерода, смысл термина «органическая химия» изменился — так теперь называют химию соединений углерода, а науку, изучающую химический состав живых организмов и химические процессы, протекающие в них, стали называть физиологической, а затем биологической химией.
- Первоначальные этапы.
Читать дальше »
Представление о белках как о классе соединений формировалось в XVIII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, хрусталик глаза, кровь, молоко и т. п.) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие, клейкие растворы, свертывались при нагревании, при их высушивании получалась роговидная масса, при «анализе огнем» ощущался запах паленой шерсти или рога и выделялся аммиак.
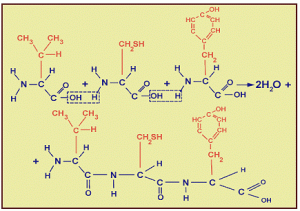
- Белки как класс соединений.
Читать дальше »
Основную роль в образовании третичной структуры играют нековалентные взаимодействия между радикалами аминокислот — водородные, ионные, гидрофобные связи. Аминокислоты, входящие в белки, различаются по физико-химическим свойствам радикалов. Между аминокислотами с неполярными (гидрофобными) радикалами возможны гидрофобные взаимодействия; между полярными радикалами возникают водородные связи, а между заряженными полярными радикалами — ионные.
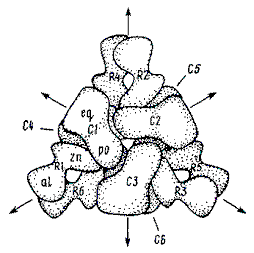
- Связи в белках.
Читать дальше »
При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и молекула целиком или в значительной части принимает форму случайного беспорядочного клубка (случайного в том смысле, что каждая молекула данного индивидуального белка по конформации может отличаться от всех других молекул).
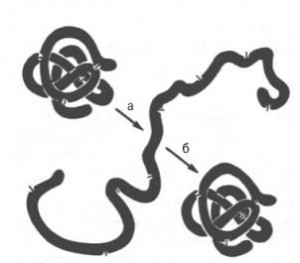
- Денатурация.
Читать дальше »
Характерная структурная особенность фибриллярных белков — вытянутая, нитевидная форма молекул. Эти белки нерастворимы в воде и часто образуют многомолекулярные нитевидные комплексы — фибриллы.
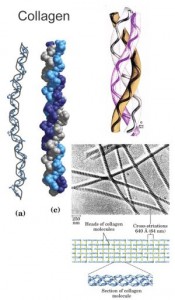
- Фибриллярный белок.
Читать дальше »
Наиболее характерная черта, отличающая ферменты от других катализаторов — высокая специфичность их действия. Активный центр ферментов, как и других белков, образован боковыми группами аминокислотных остатков пептидной цепи. Строение активных центров ферментов, катализирующих разные реакции, различно.

- Действие ферментов.
Читать дальше »
Реакции трансаминирования проходят в две стадии (полуреакции). Если к раствору фермента добавить только один из двух субстратов — аланин, то произойдет первая полуреакция. Аминогруппа аланина присоединяется к углероду альдиминной группы фермента: альдиминная связь между кофермен-том и белком заменяется на альдиминную связь между коферментом и аланином.
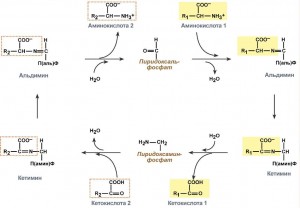
- Трансаминирование.
Читать дальше »
В реакциях, катализируемых этими ферментами, в качестве кофермента участвует никотинамидадениндинуклеотид (НАД). Две половины молекулы НАД,объединенные связью между остатками фосфорной кислоты, построены по одинаковому плану. Одна половина представляет собой остаток нуклеотида (адениловой кислоты).
- Дегидрогеназы.
Читать дальше »
Молекула кофермента А построена из аденозин-3'-фосфат-5'-пирофосфата, соединенного сложноэфирной связью с пантотеновой кислотой, которая, в свою очередь, соединена амидной связью с р-меркаптоэтиламином (тиоэтаноламином).
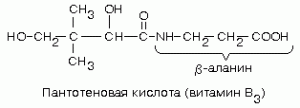
- Кофермент.
Читать дальше »
Ингибиторами ферментов называют вещества, снижающие их активность. Наибольший интерес представляют ингибиторы, взаимодействующие с активным центром фермента. Такие ингибиторы чаще всего являются структурными аналогами субстрата и, следовательно, комплементарны активному центру фермента.

- Ингибиторы.
Читать дальше »














